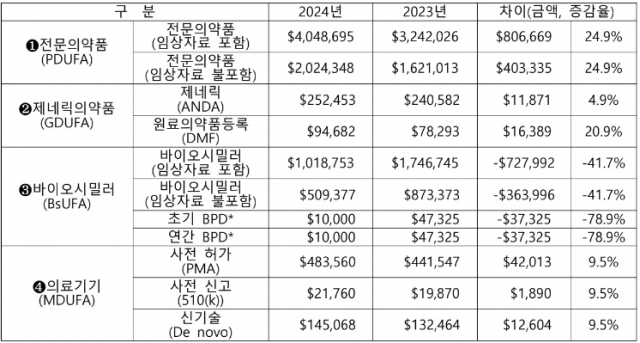
제약·바이오
[NW리포트]리보세라닙 'FDA 승인' 자신 하더니···'진양곤 설화' 또 터졌다
에이치엘비(HLB)의 '리보세라닙(rivoceranib)'이 끝내 미국 식품의약국(FDA) 벽을 넘지 못했다. 진양곤 HLB 회장은 17일 리보세라닙과 '캄렐리주맙' 병용요법의 간암 적응증 1차 치료제 신약허가신청에 대해 FDA로부터 최종보완요청서(CRL)를 받았다고 밝혔다. CRL을 수령하면 FDA가 지적한 사안을 수정·보완한 후 신약 허가 신청을 다시 제출해야 한다. FDA는 수정·보완한 내용을 받고 최장 6개월 이내에 허가 여부를 발표한다. 이